Exercice corrigé :La combustion – Rapport Energie-quantité de CO2
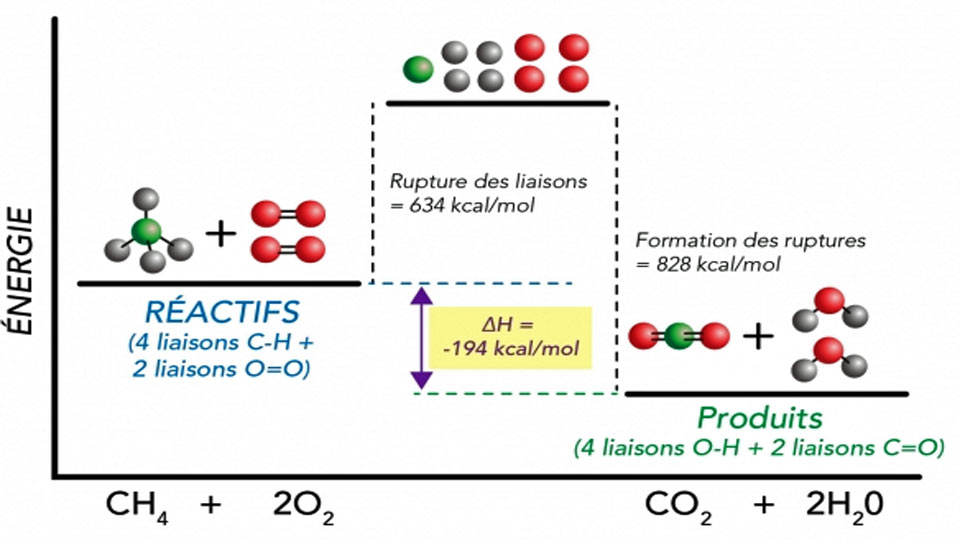
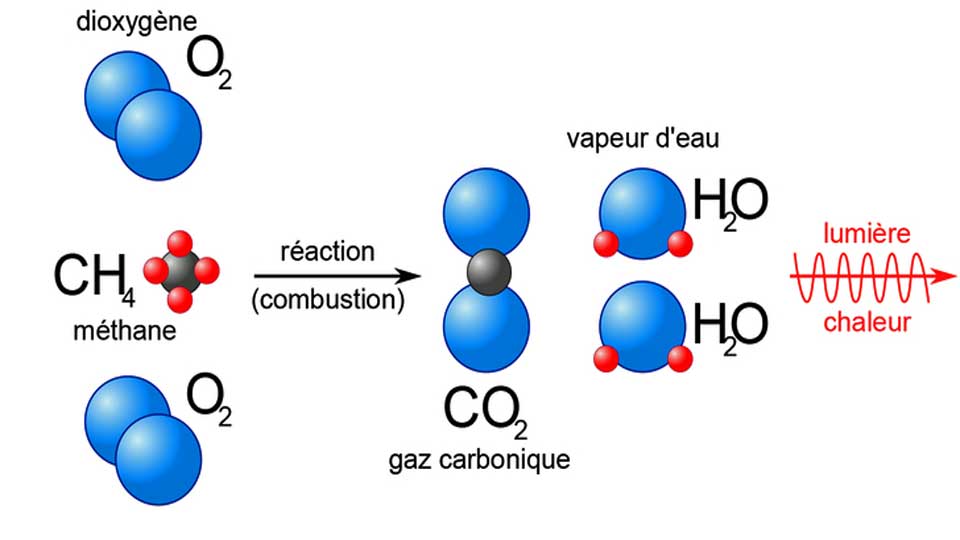
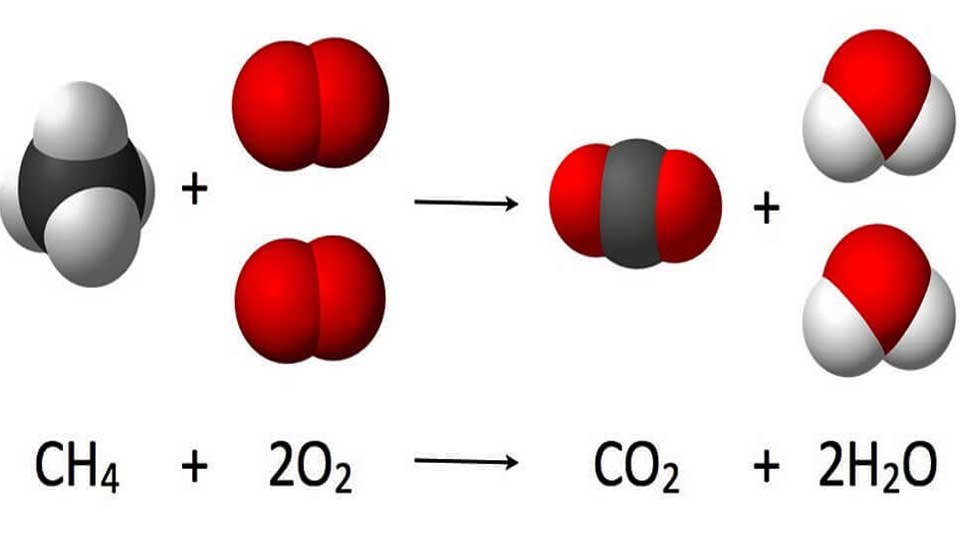
Lors de la combustion complète d’un hydrocarbure ou d’un alcool, le combustible réagit avec le comburant (le dioxygène). il y a pour formation du dioxyde de carbone et de l’eau. La combustion d’un hydrocarbure ou d’un alcool produit du dioxyde de carbone, gaz à effet de serre dont le rejet dans l’atmosphère participe au réchauffement climatique.
Une réaction de combustion est toujours exothermique (le système chimique libère de l’énergie).
On appelle énergie molaire de combustion l’énergie libérée par mole de combustible consommé. On la note Ecomb (en J.mol-1). Lors de la combustion, cette énergie chimique est convertie en d’autres formes d’énergie grâce à un transfert thermique.
Les hydrocarbures (souvent issus des pétroles) et les alcools constituent des stocks d’énergie chimique.
Exercice : La combustion – Rapport Energie-quantité de CO2
La correction :