Une constante d’acidité ou constante de dissociation acide, Ka, est une mesure quantitative de la force d’un acide en solution. C’est la constante d’équilibre de la réaction de dissociation d’une espèce acide dans le cadre des réactions acido-basiques.
On utilise généralement le Pka plutôt que le Ka pour déterminer la force d’un acide. On remarque que plus l’acide est fort plus le pKa est petit. En effet, si celui est fortement dissocié, la concentration [AH] devient faible. L’acide étant noté AH et la base A–, Ka peut également s’écrire : A cette constante d’acidité est associée une autre : le pKa, qui est également sans unité.
La différence entre le pH et le pKa.” Le pH mesure une propriété d’une solution dans l’eau. Le pKa est lié à une substance acide ou basique que l’on peut dissoudre dans l’eau.
Comment trouver le pKa à partir du pH ?
Cette propriété vient de la relation pH=pKa + log [base]/[acide]. A la demi-équivalence, on a par définition [base]=[acide] d’où pH=pKa à la demi-équivalence.
Le pKa d’un couple peut être déterminé graphiquement, en mesurant le pH de différentes solutions obtenues par des mélanges de volumes variables de l’acide et de sa base conjuguée. – On considère, lors de cette activité, qu’il n’y a pas de réaction entre les espèces conjuguées AH et A- mises en présence.
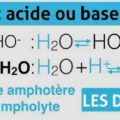
La constante d’acidité KA est la constante d’équilibre de la réaction qui modélise la transformation entre un acide AH et l’eau H2O. C’est une grandeur sans unité modélisée par la réaction d’équation chimique.
Définition du pH
Le pH est définit par la relation : pH = – log [H3O+] = – log [H+] (voir le calcul automatisé)
L’autoprotolyse de l’eau correspond à l’équilibre suivant : H2O + H2O ↔ H3O+ + OH–
La constante d’équilibre s’écrit Ke = [OH–][H+]/1 = [OH–][H+]
Cette constante d’équilibre, dépendante de la température, est également appelée produit ionique de l’eau. Il est égal à
Ke = [OH–][H+] = 10-14 à 25°C
Pour l’eau pure on a : [OH–] = [H+] = 10-7 mol /L . Le pH vaut donc 7.








More Stories
Exercice corrigé : Les Lois de Kepler
EXERCICE CORRIGE : Les réactions acido-basiques
Exercice corrigé : Acide et Base