Exercices révision: Combustion et Energie Cinétique
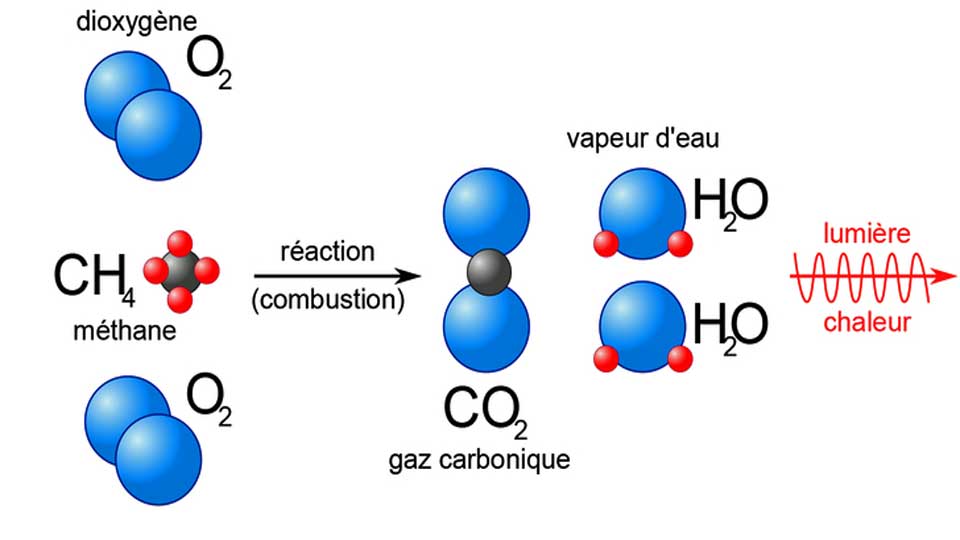
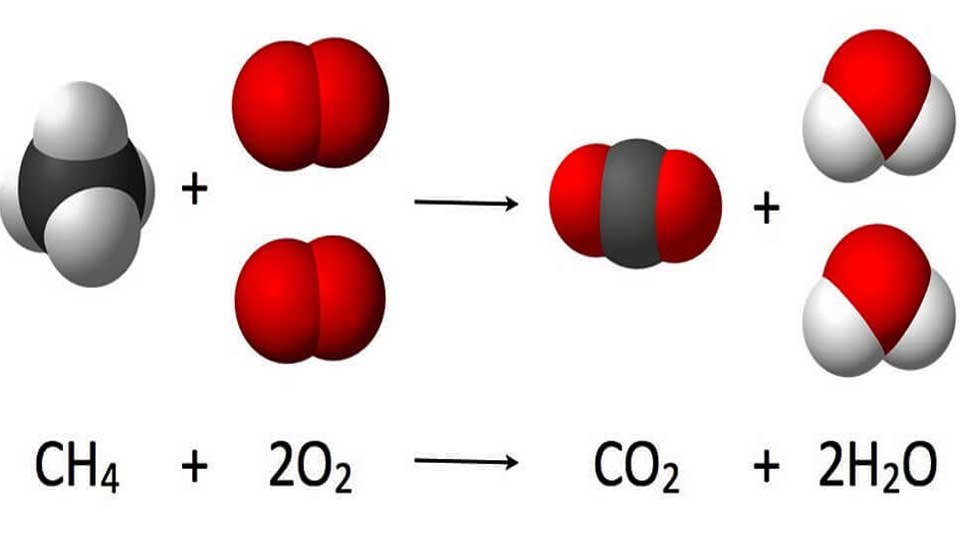
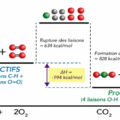
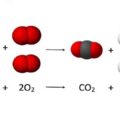
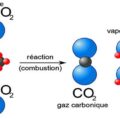
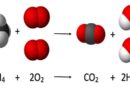
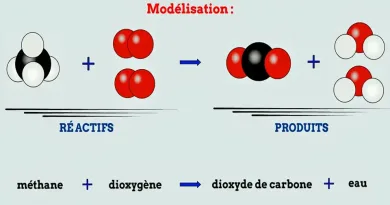
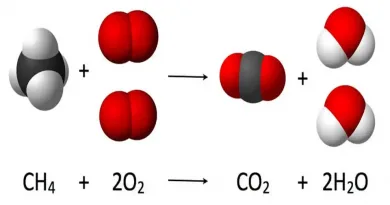
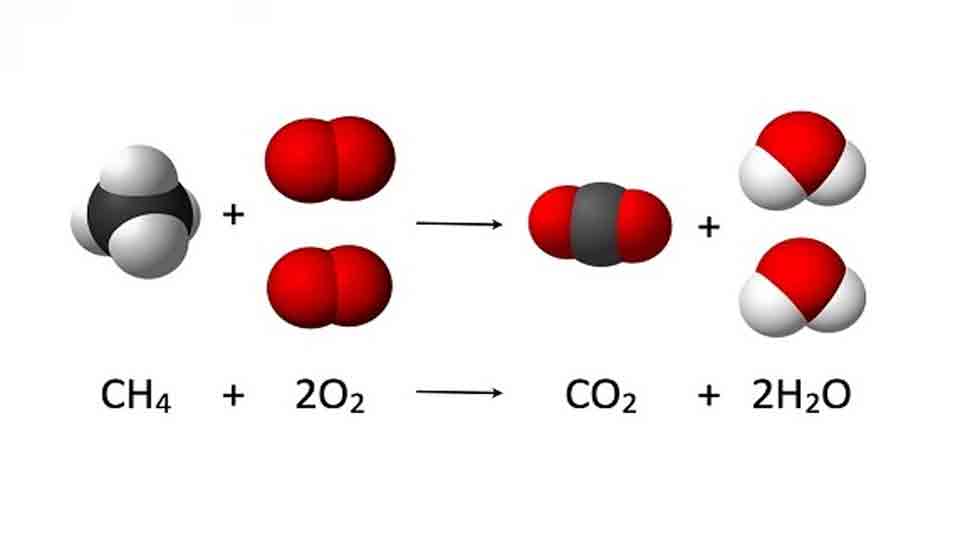
La combustion est une réaction chimique au cours de laquelle un combustible (ou carburant) est oxydé par un comburant (dioxygène, halogènes,…) avec un grand dégagement d’énergie calorifique (chaleur). Il existe une grande variété de combustibles: bois, papier, pétrole, alcool, graisses, charbon
Combustibles et pouvoirs calorifiques
Le terme « pouvoir calorifique » est employé pour décrire l’énergie qui peut être obtenue par la combustion d’un kilogramme de combustible. Ainsi, par exemple, le pouvoir calorifique moyen du bois est de 15 mégajoules par kilogramme et celui de l’essence de 47,3 mégajoules par kilogramme.
Cette énergie est concentrée dans l’eau dégagée par la réaction sous forme de vapeur. Lorsque le carburant (combustible fournissant l’énergie d’un moteur thermique) est un hydrocarbure, il y a également dégagement de dioxyde de carbone (CO2). Si la combustion est incomplète, c’est-à-dire lorsque l’alimentation en oxygène est insuffisante, il peut y avoir production d’imbrûlés (des suies qui encrassent la chaudière) ou de composés organiques volatils (COV) et, plus grave encore, d’éléments partiellement oxydés comme le monoxyde de carbone (CO), un gaz extrêmement dangereux pour l’Homme.
Théorème d’énergie Cinétique :
La variation de l’énergie cinétique d’un solide de masse m en translation dans un référentiel galiléen entre deux points A et B est égale à la somme des travaux des forces extérieures et intérieures qui s’appliquent sur le système lors de son déplacement de A à B :