Exercices corrigés sur l’énergie interne et le 1er principe

L’énergie interne et l’enthalpie sont des grandeurs d’état qui vont nous permettre de retrouver les variations d’énergie mises en jeu au cours d’une transformation . Ces grandeurs sont définies à partir de l’énoncé du premier principe de la thermodynamique.
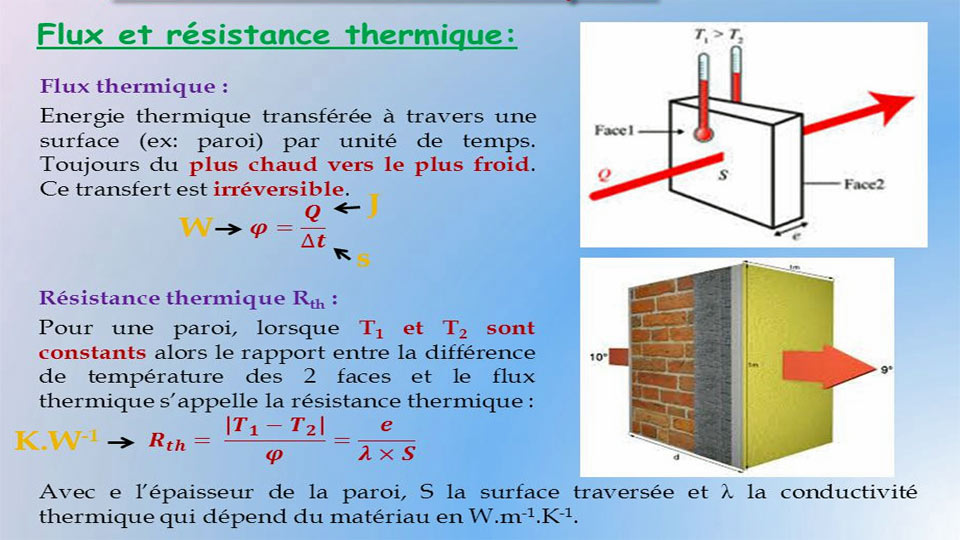
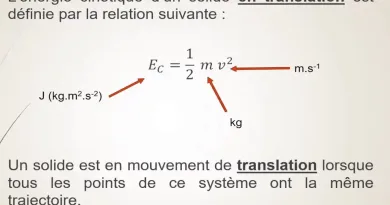
Energie interne : A partir de cette relation, on peut montrer que la somme (Q+W) ne dépend que de l’état initial et de l’état final du système ; on définit alors la grandeur d’état que l’on appelle Énergie interne telle que : ΔU = Q+W.
Le symbole Δ placé devant la lettre U signifie que ΔU est la variation de la grandeur U dans le système au cours de la transformation.
Premier principe de la thermodynamique : loi de conservation de l’énergie
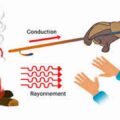
Au cours d’une transformation l’ énergie n’est ni créée ni détruite : elle peut être convertie d’une forme en une autre ( travail, chaleur ) mais la quantité totale d’énergie reste invariable.
Cette loi constitue le premier principe de la thermodynamique :
l’énergie du système + celle du milieu extérieur est constante lors d’une transformation, quelle que soit la nature de cette transformation.
On aura donc la relation suivante : ∑(𝑄+𝑊)cycle=0
où 𝑄 et 𝑊 représentent chaleur et travail échangés avec l’extérieur.
Système + celle du milieu extérieur est constante lors d’une transformation, quelle que soit la nature de cette transformation.
On aura donc la relation suivante : ∑(𝑄+𝑊)cycle = 0 où 𝑄 et 𝑊 représentent chaleur et travail échangés avec l’extérieur.