Exercices corrigés sur l’Oxydoreduction en TSTI2D
l’Oxydoréduction
Introduction à l’Oxydoréduction
Les réactions d’oxydoréduction, ou réactions redox, sont des réactions chimiques au cours desquelles il y a transfert d’électrons entre deux espèces chimiques. Elles jouent un rôle crucial dans de nombreux processus chimiques et biologiques, y compris la respiration cellulaire, la corrosion des métaux, et la production d’énergie dans les piles et batteries.
Définitions et Concepts de Base
Oxydant et Réducteur
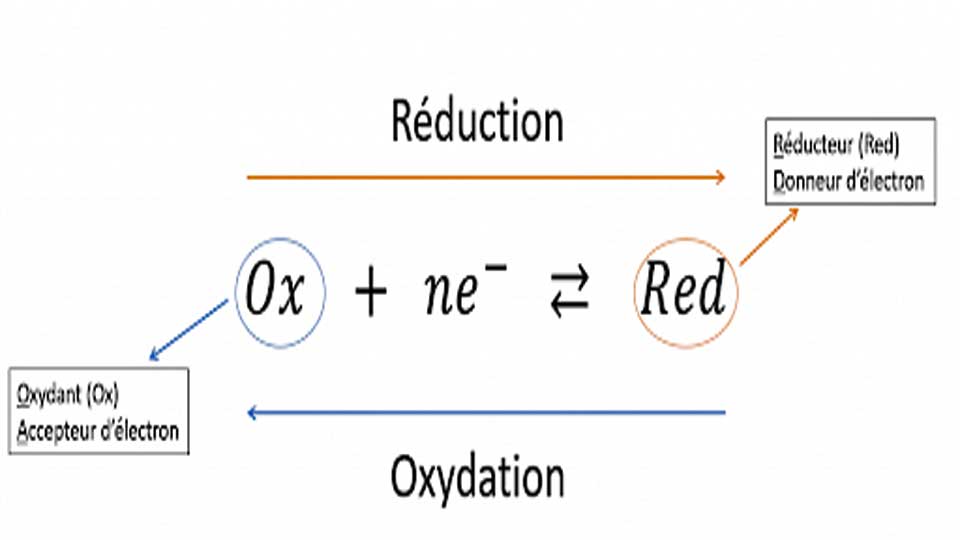
- Oxydant: Une substance qui accepte des électrons lors d’une réaction chimique. En acceptant des électrons, l’oxydant est réduit.
- Réducteur: Une substance qui donne des électrons lors d’une réaction chimique. En donnant des électrons, le réducteur est oxydé.
Réaction d’Oxydoréduction
Une réaction d’oxydoréduction peut être décomposée en deux demi-réactions:
- Demi-réaction d’oxydation: Le réducteur perd des électrons. Reducteur→Oxydant+e
- Demi-réaction de réduction: L’oxydant gagne des électrons. Oxydant+electrons→Reducteur
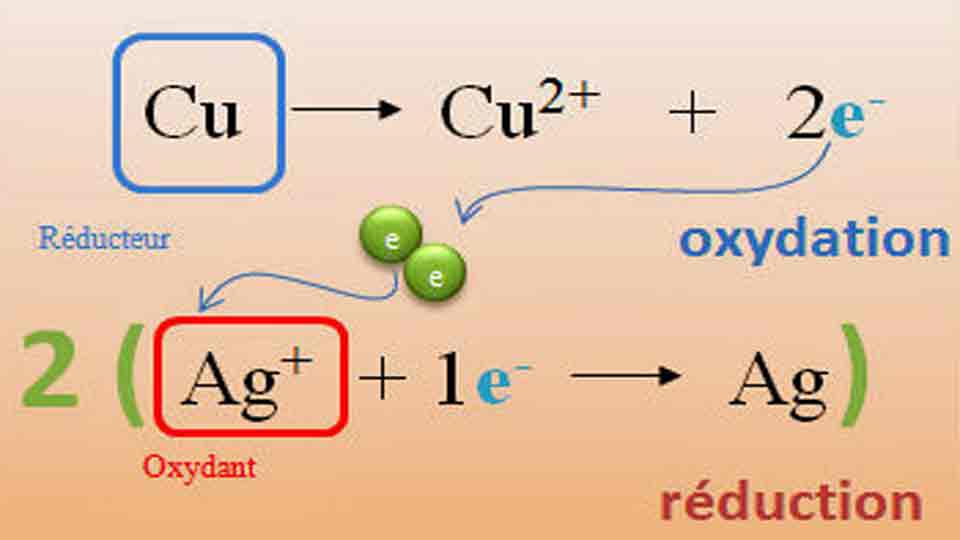
Exemple de Réaction d’Oxydoréduction
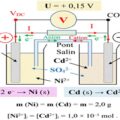
Prenons l’exemple de la réaction entre le zinc (Zn) et les ions cuivre : Zn+Cu2+→Zn2++Cu
Demi-réaction d’oxydation (le zinc perd des électrons): Zn→Zn2++2eˊ
Demi-réaction de réduction (les ions cuivre gagnent des électrons): Cu2++2eˊ−→Cu
Potentiel Redox
Le potentiel redox, ou potentiel d’électrode, est une mesure de la tendance d’une substance à gagner ou perdre des électrons. Il est mesuré en volts (V) par rapport à une électrode de référence. Plus le potentiel redox est élevé, plus la substance a tendance à se réduire (agir comme un oxydant).