EXERCICE AVEC CORRECTION SUR LA COMBUSTION AVEC RAPPEL DE COURS
La combustion complète et incomplète et le calcul des enthalpies
1. Introduction à la combustion
La combustion est une réaction chimique exothermique entre un combustible et un comburant, généralement l’oxygène de l’air, produisant de la chaleur et souvent de la lumière. La combustion peut être complète ou incomplète en fonction de la disponibilité de l’oxygène.
2. Combustion complète
Définition : La combustion complète se produit lorsque le combustible brûle en présence d’une quantité suffisante d’oxygène, produisant des produits de combustion parfaitement oxydés, comme le dioxyde de carbone (CO2) et l’eau (H2O).
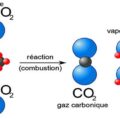
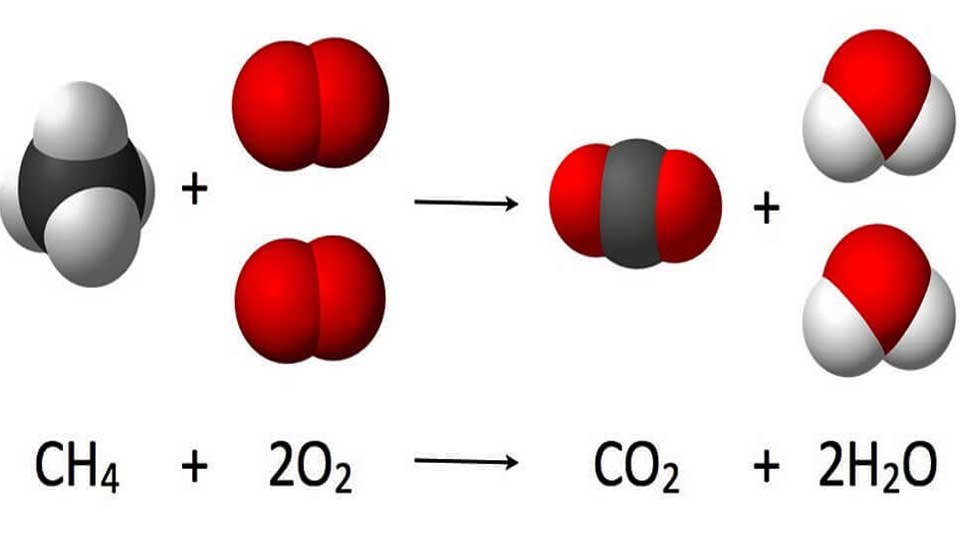
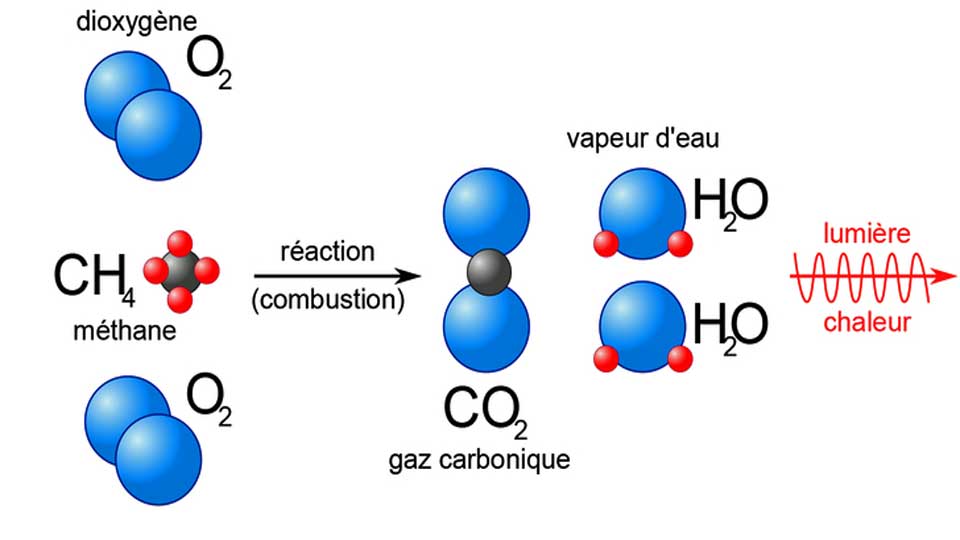
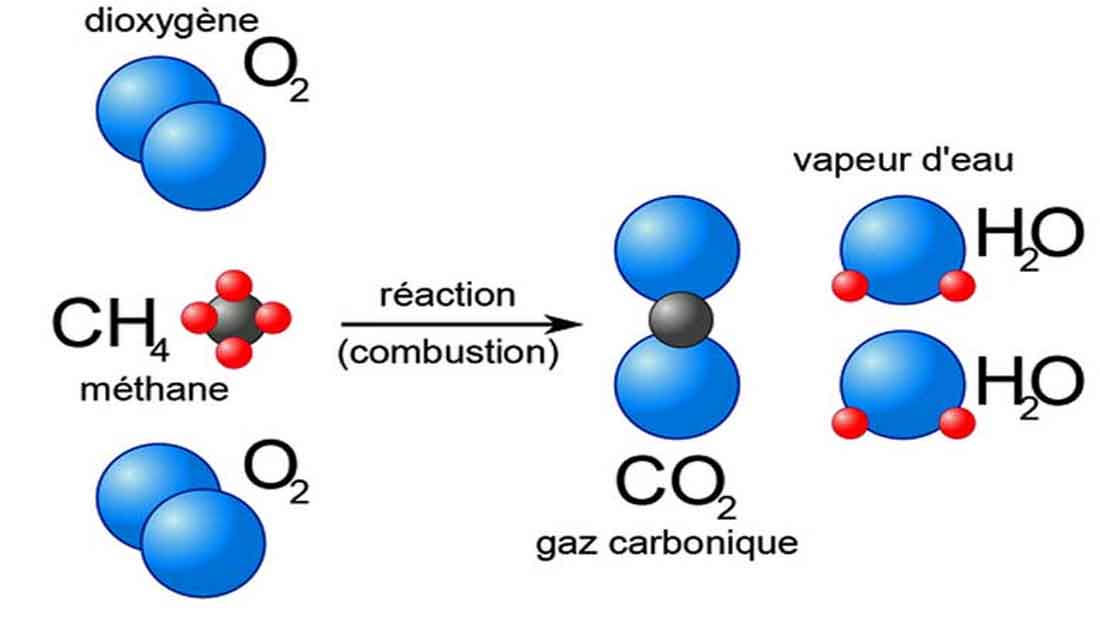
Équation générale de la combustion complète : Combustible + O2 → CO2 + H2O + Énergie
Exemples de combustion complète :
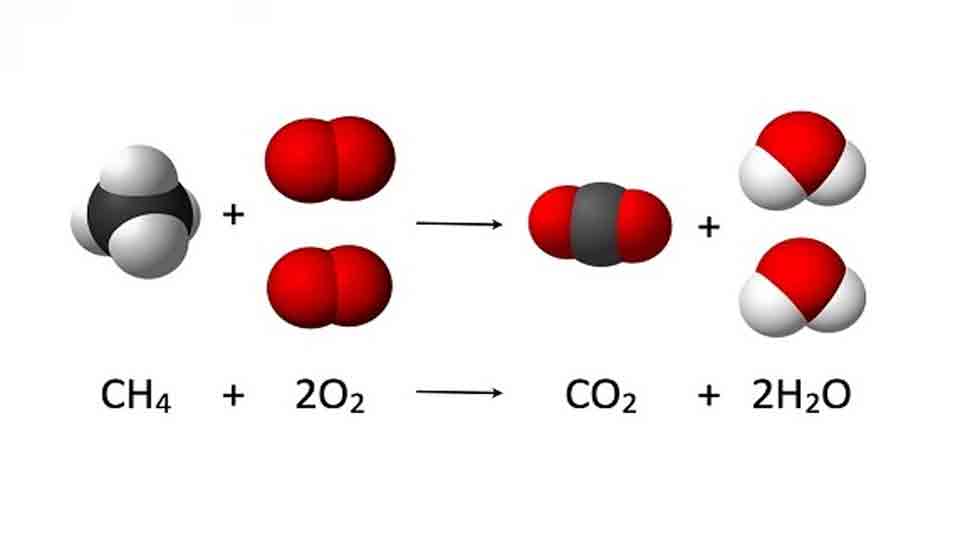
- Combustion du méthane (CH4) : CH4 + 2 O2 → CO2 + 2 H2O
- Combustion du propane (C3H8) : C3H8 + 5 O2 → 3 CO2 + 4 H2O
3. Combustion incomplète
Définition : La combustion incomplète se produit lorsque le combustible brûle en présence d’une quantité insuffisante d’oxygène, produisant des produits de combustion partiellement oxydés, comme le monoxyde de carbone (CO) et de l’eau (H2O).
Équation générale de la combustion incomplète : Combustible + O2 → CO + H2O + Énergie (moins d’énergie que la combustion complète)
Exemple de combustion incomplète :
- Combustion du méthane (CH4) : 2 CH4 + 3 O2 → 2 CO + 4 H2O
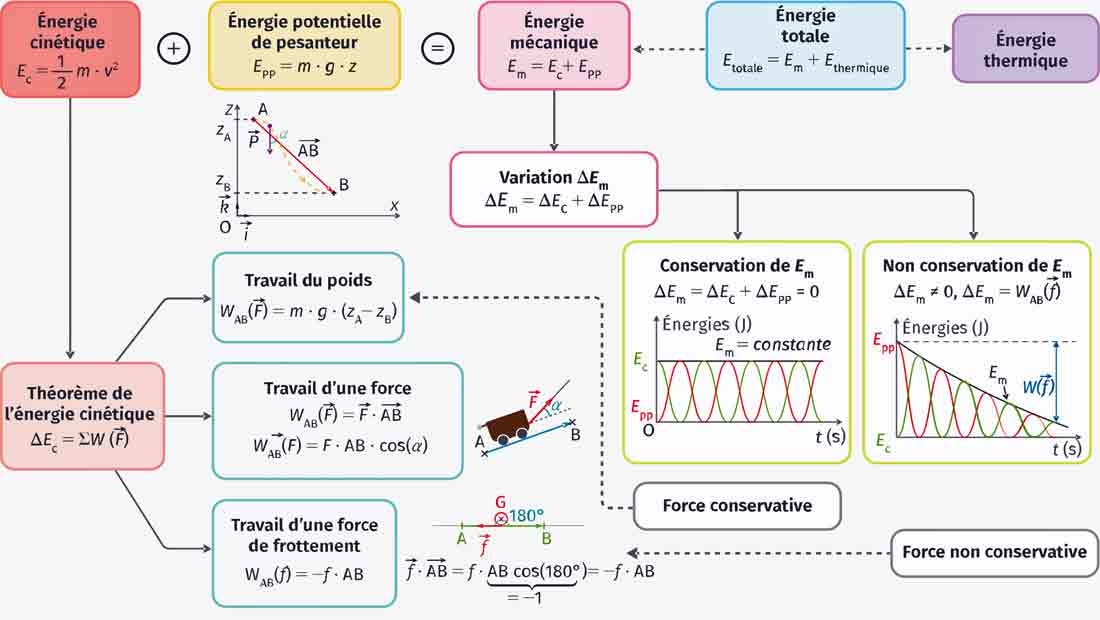
4. Calcul des enthalpies de réaction
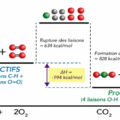
L’enthalpie de réaction (ΔHr) est la variation d’enthalpie au cours d’une réaction chimique. Elle peut être calculée en utilisant les enthalpies de formation standard (ΔHf°) des réactifs et des produits.
Formule : ΔHr = Σ ΔHf°(produits) – Σ ΔHf°(réactifs)
Exemples de calcul des enthalpies de combustion complète :
- Combustion du méthane (CH4) :Équation équilibrée : CH4 + 2 O2 → CO2 + 2 H2OEnthalpies de formation standard (ΔHf°) :
- ΔHf°(CH4) = -74,8 kJ/mol
- ΔHf°(O2) = 0 kJ/mol
- ΔHf°(CO2) = -393,5 kJ/mol
- ΔHf°(H2O) = -241,8 kJ/mol
Calcul de l’enthalpie de réaction (ΔHr) : ΔHr = [ΔHf°(CO2) + 2 ΔHf°(H2O)] – [ΔHf°(CH4) + 2 ΔHf°(O2)] ΔHr = [-393,5 + 2(-241,8)] – [-74,8 + 2(0)] ΔHr = [-393,5 – 483,6] – [-74,8] ΔHr = -877,1 + 74,8 ΔHr = -802,3 kJ/mol
La combustion de 1 mol de méthane libère donc 802,3 kJ d’énergie.
- Combustion du propane (C3H8) :Équation équilibrée : C3H8 + 5 O2 → 3 CO2 + 4 H2OEnthalpies de formation standard (ΔHf°) :
- ΔHf°(C3H8) = -103,8 kJ/mol
- ΔHf°(O2) = 0 kJ/mol
- ΔHf°(CO2) = -393,5 kJ/mol
- ΔHf°(H2O) = -241,8 kJ/mol
Calcul de l’enthalpie de réaction (ΔHr) : ΔHr = [3 ΔHf°(CO2) + 4 ΔHf°(H2O)] – [ΔHf°(C3H8) + 5 ΔHf°(O2)] ΔHr = [3(-393,5) + 4(-241,8)] – [-103,8 + 5(0)] ΔHr = [-1180,5 – 967,2] – [-103,8] ΔHr = -2147,7 + 103,8 ΔHr = -2043,9 kJ/mol
La combustion de 1 mol de propane libère donc 2043,9 kJ d’énergie.
5. Importance de la combustion complète et incomplète
Efficacité énergétique :
- La combustion complète maximise l’énergie extraite du combustible.
- La combustion incomplète produit moins d’énergie et est moins efficace.
Impact environnemental :
- La combustion complète minimise la production de polluants nocifs tels que le monoxyde de carbone (CO) et les hydrocarbures non brûlés.
- La combustion incomplète produit des polluants qui sont dangereux pour la santé humaine et l’environnement.
Applications pratiques :
- La combustion complète est utilisée dans les moteurs à combustion interne, les chaudières, les fours et autres dispositifs où une combustion efficace est nécessaire.
- La combustion incomplète doit être évitée pour améliorer l’efficacité énergétique et réduire les émissions polluantes.
La compréhension des processus de combustion complète et incomplète est essentielle pour optimiser les systèmes de combustion, améliorer l’efficacité énergétique et minimiser les impacts environnementaux. Les calculs d’enthalpie permettent de quantifier l’énergie libérée lors de ces réactions, ce qui est crucial pour la conception et l’optimisation des applications industrielles et domestiques utilisant la combustion.
EXERCICE AVEC CORRECTION SUR LA COMBUSTION