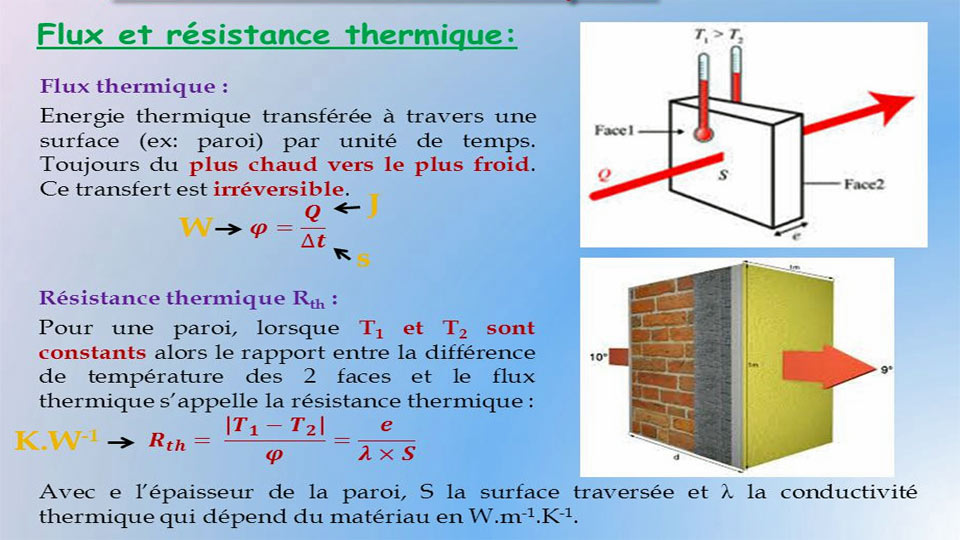
Exercices corrigés sur les Gaz parfaits
La température : La température représente l’énergie d’agitation des entités chimiques du milieu considéré. Dans la pratique, la température d’un milieu est repérée par un thermomètre.
Son unité dans le système international est le kelvin (K). Elle est reliée à la valeur en degré Celsius par : T(K) = T(°C) + 273,15.
Le zéro absolu, exprimé en kelvin. Elle correspond à la plus petite valeur que peut prendre la température soit 0 K = −273,15 °C.
Le modèle et la loi des gaz parfaits : Le modèle du gaz parfait suppose que les atomes ou les molécules qui le composent sont très petits comparativement à la distance moyenne qui les sépare (et qu’on appelle distance intermoléculaire moyenne) : ils sont donc considérés comme étant ponctuels.
De plus, en dehors des chocs lorsqu’elles se rencontrent, ces particules n’interagissent pas puisqu’elles n’exercent aucune interaction à distance.
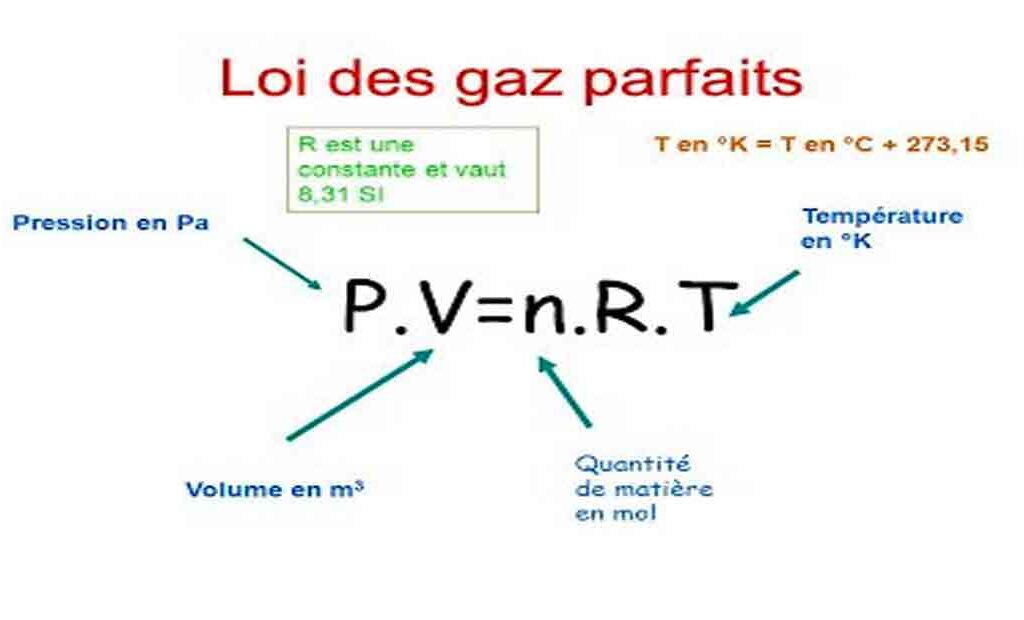
La loi des gaz parfaits est une équation d’état qui relie les différentes grandeurs thermodynamiques d’un gaz considéré comme parfait. Elle s’écrit de la façon suivante : PV = n RT
Avec :
P représente la pression du gaz, en Pascal (Pa) ;
V représente le volume dans lequel il est contenu, en m3 ; et n la quantité de matière de gaz en mol ;
R représente la constante des gaz parfaits : R=8,314J⋅K−1⋅mol−1 ; T la température du gaz, en kelvin (K).